2020年10月14日,兰州大学黎家课题组在PNAS在线发表了题为“Loss of the common immune coreceptor BAK1 leads to NLR-dependent cell death”的研究论文。该文揭示了植物免疫响应中的R蛋白ADR1s负责调控bak1bkk1自身免疫表型的分子机制。
研究背景
在应对病原菌入侵时,植物的天然免疫系统会先后触发两层响应机制:第一层由植物细胞利用位于质膜之上,对病原微生物保守的相关分子模式(Pathogen-associated molecular pattern,PAMP)进行识别的模式识别受体(Pattern-recognition receptors,PRRs)来完成。该系统能够激发PTI(PAMP-Triggered Immunity),实现对病原物的基础抗性;第二层则是通过位于细胞内抗病基因编码的多态性抗病蛋白(R Protein),直接或间接识别病原效应蛋白(Effector)来完成。该系统能够触发ETI(Effector-Triggered Immunity),实现更为专一且强烈的免疫反应(通常体现为过敏性反应引起的细胞死亡)。
PTI通路中的宿主对PAMP的识别以及信号转导的起始除去特异的受体外还需要膜上的共受体参与调控。拟南芥BAK1(BRI1 Associated Receptor Kinase 1)是一类LRR-RLK(Leucine-rich Repeat Receptor-like Protein Kinase)从属于包含5名成员的SERK家族,其最早在BR信号受体研究中鉴定得到。除BR信号外,BAK1还被证明通过flg22(PAMP)与FLS2(flg22受体)互作,并通过激酶活性向下游传递免疫信号。2007年黎家研究团队得到BAK1及其同源BKK1的双突变体,研究发现两者BR信号响应出现异常之外,还表现出因抗病基因组成表达而产生的幼苗致死表型。暗示bak1 bkk1参与细胞死亡相关的信号调控过程,但具体的分子机理一直未知。
主要创新点
在该研究开篇,由于早期研究已观察到bak1-4 bkk1-1(两基因完全功能缺失allele)即使在无菌培养条件下,萌发14天左右也会致死的表型。作者提前一周在细胞死亡现象刚发生时,利用转录组对表型相关的调控基因进行挖掘。结果表明双突变体中受上调表达的普遍为SA合成、信号转导,细胞死亡等通路相关基因。因此作者判定bak1 bkk1幼苗死亡是一种R基因失调介导的自身免疫现象。紧接着通过分析R基因的表达水平,作者寻找到该类R基因包括ADR1、UNR1、RPS5三类亚家族成员。进一步利用RNAi干扰技术,敲低特定亚家族R基因的表达水平,作者期望寻找到bak1-3 bkk1-1(BAK1功能未完全丧失allele)自身免疫表型依赖的R蛋白,结果发现ADR1亚家族成员特异调控bak1-3 bkk1-1的细胞死亡。由于该ADR1亚家族成员包括ADR1/ADR1-L1/ADR1-L2,作者随即使用遗传学手段将三者与bak1-3 bkk1-1进行组合突变,发现在bak1 bkk1双突变体中引入ADR1s突变越多,植物叶片细胞死亡现象越弱。而adr1s bak1 bkk1五突变体则能够完全阻断bak1 bkk1的表型。该结果表明BAK1、BKK1介导的细胞死亡途径受ADR1s所特异调控。
由于BAK1已被证明主要参与植物免疫的PTI过程,而R蛋白是在ETI过程中发挥调控作用。作者需要进一步探究bak1 bkk1中PTI以及ETI通路调控能力的差异。通过PAMP(flg22)处理的方式,bak1 bkk1双突变体以及adr1s bak1 bkk1五突变体在植物经典PTI响应即ROS迸发、MAPK(MPK3/6)激活、标志基因(FRK1)表达三个方面强度均要显著弱于野生型对照,而突变体之间无明显差异,该结果表明bak1 bkk1中PTI信号响应被削弱。而在ETI方面,作者通过接菌Pst DC3000 avrRpt2来触发AvrRpt2相关的ETI通路(ADR1s已被证明可参与调控该通路),结果表明bak1 bkk1对该病原菌表现出显著抗性,而adr1s bak1 bkk1的抗性被削弱。此结果说明bak1 bkk1中植物的ETI响应增强,该过程依赖ADR1s亚家族成员的功能。
紧接着作者试图将BAK1、BKK1在PTI和ETI之间的调控作用与病原物效应子的作用相互结合以进行具有生理意义的研究。作者合作团队(周俭民研究组)在先前研究中已鉴定得到丁香假单胞菌(Pst)分泌的效因子HopB1可以特异靶向并切割flg22激活后的BAK1。作者因此使用化合物诱导的方式在植物体内表达HopB1,并验证HopB1对BAK1的调控作用是否激活ADR1s相关的ETI通路,最终在植物组织水平诱发细胞死亡现象。结果表明在WT中只有在处理flg22激活BAK1同时施加雌二醇对HopB1进诱导表达后,植株个体出现矮小,过氧化氢积累,抗病基因(PR1)上调表达等细胞死亡特征,而该现象在adr1s三突中不会出现。结合诱导HopB1后ADR1s同时上调表达的定量结果,作者认为利用HopB1人工诱导体系可以模拟出bak1 bkk1的自身免疫表型。
在最后一步,作者需要利用真实的病原宿主互作系统来验证以上结果。有鉴于此,作者在无效应子的Pseudomonas fluorescens Pf0-1株系中过表达HopB1效因子并进行接菌实验。结果表明野生型植株对该人工构建病原株系的抗性以及叶片注射位点附近细胞死亡水平要显著高于adr1s三突变体。结合以上实验结果,作者认为病原菌可以通过HopB1干扰宿主BAK1参与的PTI通路,宿主而相应激发ADR1s依赖的ETI通路进行应对。
以图解文
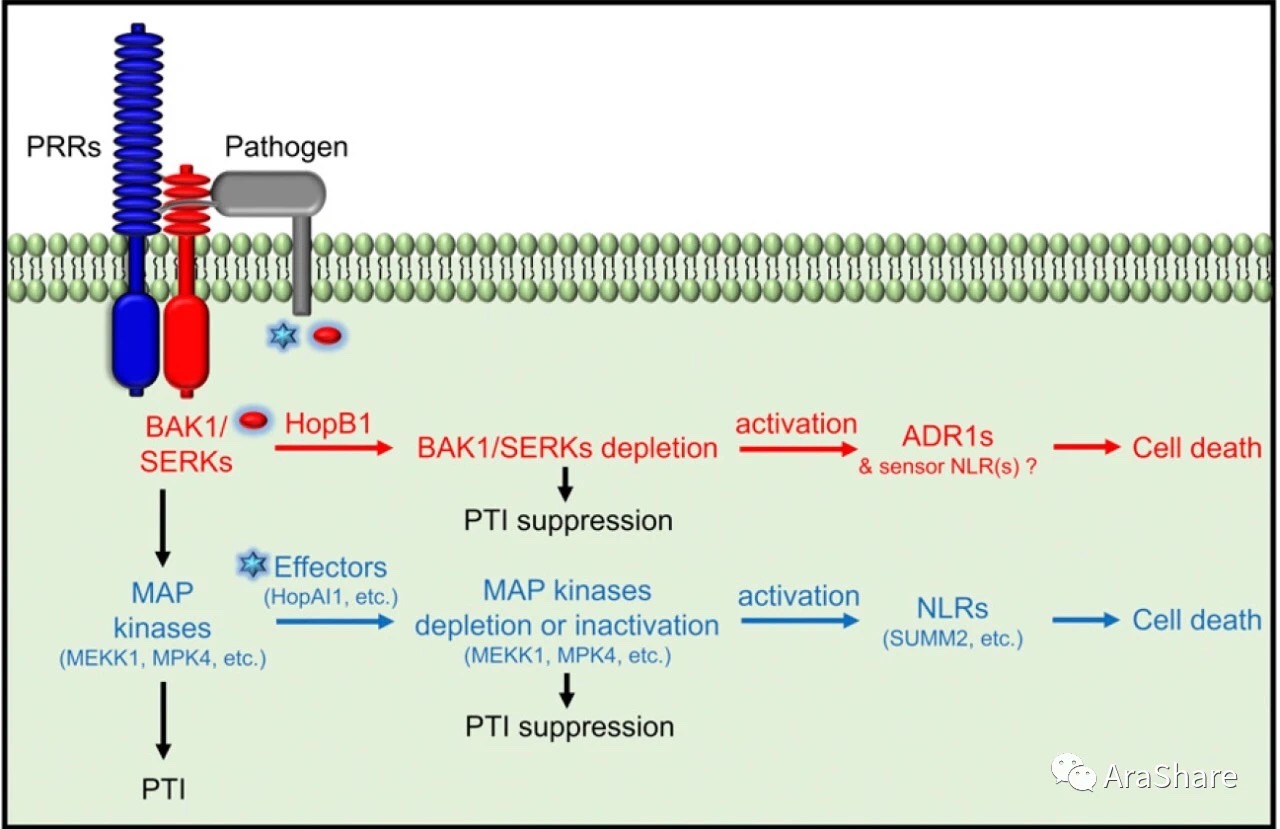
R蛋白ADR1s介导调控bak1bkk1的自身免疫途径。植物免疫系统响应通路由PRR Signaling和NLR Signaling两部分构成。前者负责介导细胞的基础抗性,具有广谱性。而后者引发更为强烈的抗性,具有专一性。BAK1作为宿主细胞识别系统PRRs的共受体,能够将免疫信号以磷酸化的方式通过MAPK级联触发PTI。病原菌通过向胞内分泌效因子的方式反制PTI以增强自身致病力。HopB1作为效因子的一员可以靶向已由PAMP激活的BAK1并使之降解。R蛋白ADR1s可以帮助NLRs感应组分用于识别特定PTI通路元件的功能完整性,并在HopB1干扰BAK1之后启动ETI信号响应,使病原侵染位点的细胞死亡,以帮助植物对抗病原菌入侵。
论文意义与展望
该文以BAK1极其同源物BKK1因功能丧失而表现出的自身免疫表型为出发点,主要借助组学及遗传学等分析手段,挖掘并解析了参与该通路的R蛋白(ADR1s)的调控手段,并将该过程与病原物效因子HopB1的作用相互紧密联系。为详细诠释植物与病原互作的调控过程打下基础,对农业生产应用中病害防控方向提供了新思路。
作者贡献与课题组简介
兰州大学Yujun Wu为该论文第一作者。黎家教授及何凯教授作为共通讯作者。中科院遗传发育研究所周俭民研究员提供合作。黎家教授与何凯教授课题组长期从事BR信号转导的相关研究,并在该领域取得了极其丰硕的成果。BAK1为黎家教授在John C Walker研究团队进行BR信号受体bri1的相关研究中鉴定得到,而bak1 bkk1的细胞死亡表型由何凯教授发现。BAK1相关的免疫信号研究也是黎家教授研究团队常年致力深入挖掘的领域之一。
新闻链接:https://mp.weixin.qq.com/s?__biz=MzIxOTY1NzU5OQ==&mid=2247485976&idx=3&sn=11228b70ac9f3f1b8189616ce5444a55&chksm=97d6ae08a0a1271ec42ecea9116c6abf31b4b25c3a2ad480bf609b35c36bf177c543df8688d4&mpshare=1&scene=1&srcid=1015he9f85URuNExGcFET8Rm&sharer_sharetime=1602772205231&sharer_shareid=0c22dac6081899c063be299c4425ecb1&exportkey=A%2B%2F5aUZpJSWYJvecQ26l4H4%3D&pass_ticket=azxr3a29hlJIIqBpaqMizFabui%2FydiSgHQPUuhgiaorTGd5TMkc60O3yUK%2Fvf1fn&wx_header=0#rd


